东胜龙 ETC811Plus PCR仪性能不输进口仪器!替代国外仪器的绝佳选择!
时间:2024-04-19 来源:EASTWIN浏览次数:71

两种常用 PCR 仪的性能验证与评价
聚合酶链式反应(Polymerase Chain Reaction,PCR)是一种在体外放大扩增特定 DNA 片段的分子生物学技术。PCR 技术主要由高温变性、低温退火及适温延伸等几步反应组成。经过多个循环,目的片段能够迅速、大量扩增。由于 PCR 技术具有特异性强、灵敏度高等优点,所以近些年利用 PCR 技术对食源性微生物进行快速检测的方法发展的十分迅速[1]。
近年来 PCR 仪品牌不断增加,各种 PCR 仪温度调控的准确性也得到了广泛的关注。不同厂家生产的仪器,热温度特性也不尽相同。即便是同一台仪器,由于其使用年限不同,其升降温速率、温度准确性和温度一致性等相关性能也会发生变化,这些细微的偏差就很可能导致扩增结果出现假阴性或假阳性。在做PCR 检测时,内外界许多因素都会对扩增结果产生影响,但在这些影响因素中 PCR 仪的温度特性起着至关重要的作用[2-4]。因此,运用 PCR 技术对食源性致病菌进行快速检测的过程中,对仪器运行温度的准确性和均一性要求很高,运行温度上的细微差别可能会导致两种不同结果的出现。
目前市面上对 PCR 仪的状态和性能进行评估仅依靠 PCR 仪鉴定来完成,其弊端是传感器无法准确反映 PCR 仪实际工作情况而且检定数据采样时间长。为此,利用已知含量的 DNA 模板对 PCR 仪的日常性能确定与评价就显得十分必要[5]。
国产仪器在工艺与性能方面不断进步、不断提高,与进口 PCR 仪相比不仅价格低,在操作界面也更符合中国人的操作习惯。《检测和校准实验室认可准则》 CNAS-CL01: 2006 (等同于 ISO/ IEC17025:2005)也明确要求实验室对设备进行期间核查[6]。为保证实验关键设备的量值溯源性,实验室会定期对实验设备进行检验和校准,以确保测量结果的准确和可靠性,但是定期的检验和校准仍然无法保证设备的持续有效性及稳定性,这是因为设备的机械性能、光学特性和电子性能等自身特性的原因,在整个 PCR 反应过程中出现的不稳定现象。仪器的稳定运行是保证结果稳定可靠的重要基础条件。因此,新仪器在使用前的验证及评价尤为重要。
本文通过对 Eppendorf GSX1和 ETC 811 PLUS 退火温度控制的准确度这一性能进行了比对与验证,进而进行评估,了解结果差异性与一致性,以期寻找国产仪器可替代国外产品的可能性。
东胜龙 ETC 811 PLUS PCR 仪[苏州东胜兴业科学仪器有限公司];Eppendorf GSX1 PCR 仪[德国Eppendorf 公司];Heraeus Fresco 21 型冷冻离心机[美国 Thermo 公司];Mili-Q 纯水器[美国 Milipore 公司];MB-202 金属浴[杭州博日公司];AlphaImager HP凝胶成像分析系统[美国 ProteinSimple];PowerPacTMBasic 电泳仪[美国伯乐公司]等。仪器设备均在校准效期内。
pSC17 质粒,引物由上海捷瑞生物技术合成。TaKaRa PCR Amplification Kit 预混合液、TAE 电泳缓冲液等。
采用温度敏感性序列 pSC17 质粒为模板,稀释为10 000个拷贝作为目的基因片段,分别使用Eppendorf GSX1 和 ETC 811 PLUS 进行 PCR 反应。M13 引物序列见(表 1)。
表 1 引物序列
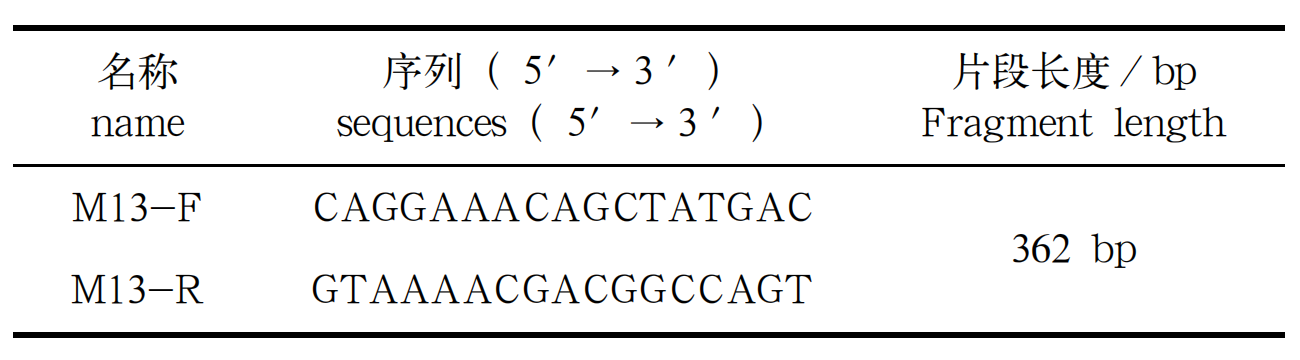
取 PCR 产物 5μL 进行琼脂糖凝胶电泳,染色观察 PCR 产物片段大小。应用 Gel Extraction Kit 试剂盒从琼脂糖凝胶中回收并纯化 362 bp 处的目的片段,将回收产物在核酸检测板中上样 2μL,应用酶标仪分析回收产物的浓度。
分别将回收产物稀释为 10³、10²、10 copies/μL三个浓度,置于 PCR 仪内运行热循环程序,VAL 引物序列见表 2。96 孔板放置位置见图 1,分别在两个PCR 仪上进行反应。
表 2 引物序列
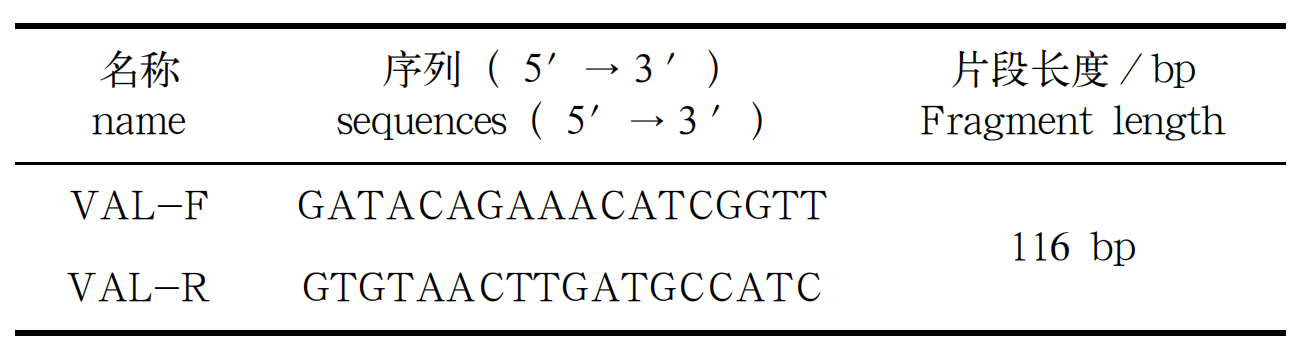
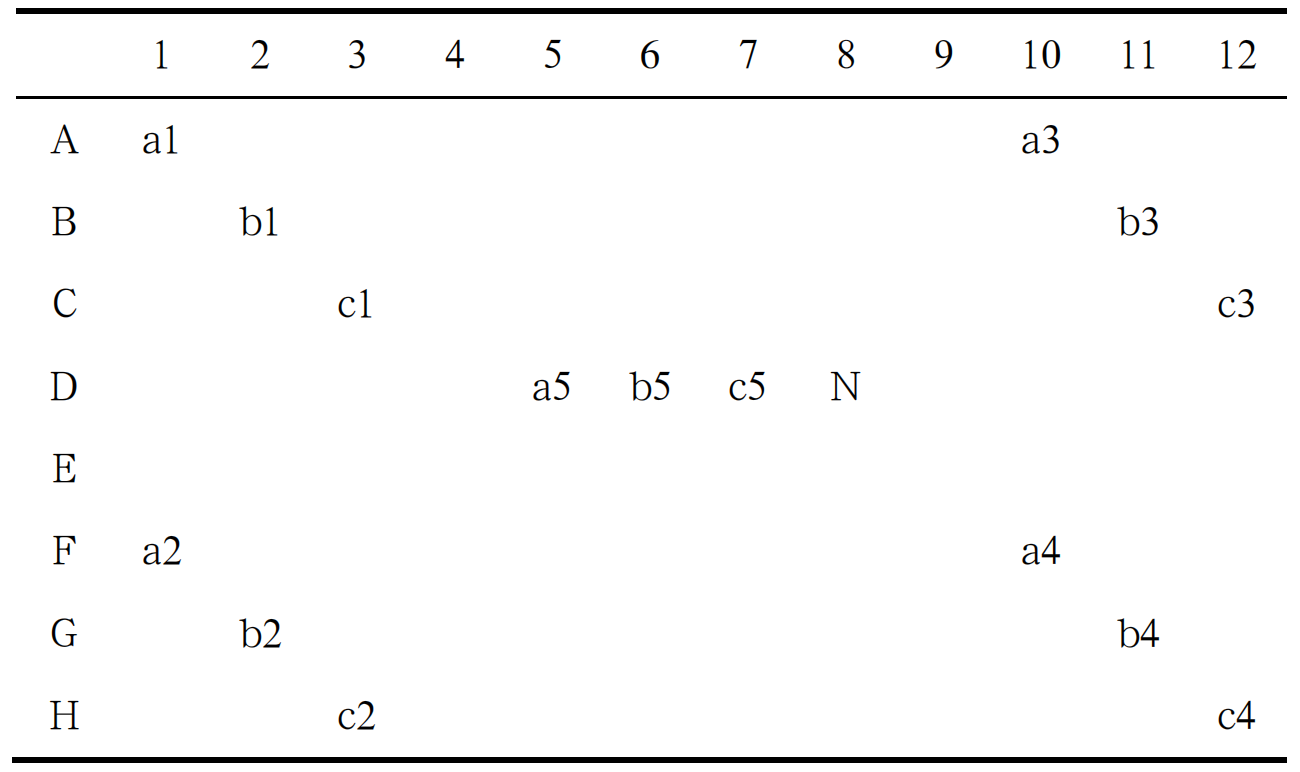
注:a、b、c、N 分别为 103 、102、10 copies/ μL 模板、N 为阴性对照
Eppendorf GSX1 和 ETC 811 PLUS 两台 PCR 仪以回收 PCR 产物为模板进行 PCR 扩增,1.2% 琼脂糖凝胶电泳,并测定产物浓度。可以看出两台 PCR 仪器均能在 362 bp 左右处产生特应性条带(图 2)。浓度测定结果分别为1.87*1010copy/μL 、1.94*1010copy/μL(表 2),可以看出两台 PCR 仪所测浓度差异不大。
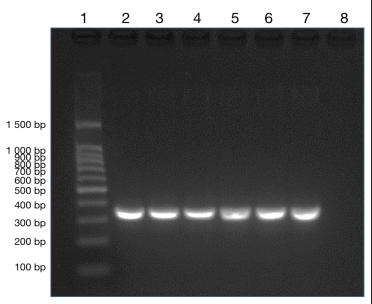
表 2 362bp 目的片段产物浓度测定结果
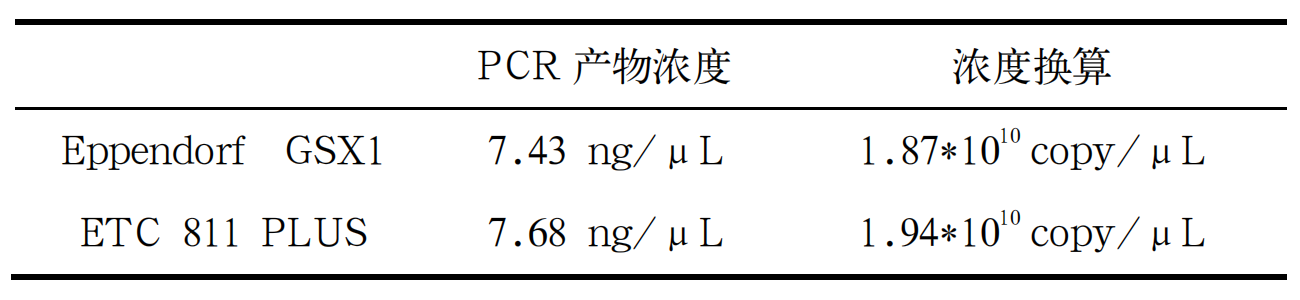
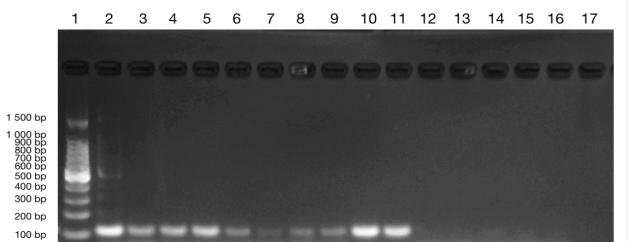
将 2.2.3 所述的稀释、扩增后的样本进行 PCR 扩增,1.2%琼脂糖凝胶电泳,Eppendorf GSX1 PCR 仪A1-A5 孔、B1-B5 孔,即 103、102copies/μL 的模板均能在 116 bp 左右处产生特应性条带。其中 C1-C5 孔,即 10 copies/μL 的模板条带不明显或无条带,其中Eppendorf GSX1 PCR 仪 C2、C3、C4 处可见不明显条带、ETC 811 PLUS PCR 仪 C3、C4、C5 处可见不明显条带(图 3、4)。
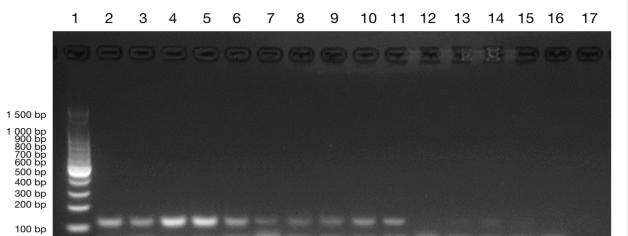
图 3 PCR 产物纯化后(Eppendorf GSX1)
参考 SN/T 2102.2-2008 的判定原则,当 5000、500copies/PCR 的样品管中都可检测到 PCR 产物,不论 50 copies/PCR 管中是否可检测到产物,都是可接受结果[8]。两台 PCR 仪均未出现不可接受结果。
与分离培养法、形态观察法、生化鉴定法、血清分型法等传统的鉴定方法相比,核酸技术有着检测周期短、灵敏度高等优点,核酸技术不仅可以实现对致病菌的快速检出,同时也能更好地认知微生物间、物种与功能基因间的相互作用机制,对防止食源性疾病的爆发和食源性致病菌的传播具有重要意义[7]。
实验室硬件条件会对核酸检测结果产生影响。因此,实验仪器性能验证是基因检测实验室欠缺和亟待提高的重要内容。但目前精密检测设备基本被国外垄断,所以加快精密仪器的国有化进程,降低成本,推动民族品牌企业发展就显得尤为重要。
本研究依据随机取样原理,参考了行业标准 SN/T2012.2《食源性病原体 PCR 灵敏度、重复性检测技术规范第 2 部分:PCR 仪性能试验要求》选取了特征孔,对 Eppendorf GSX1 和 ETC 811 PLUS 两台 PCR 仪性能进行整体评价[9]。Eppendorf GSX1 和 ETC 811PLUS 两台仪器均可达到检测食源性病原体要求。在本次试验中,且两台仪器均具有较好的重复性,且均未出现故障、稳定性好、操作方便、检测快速。符合实验室质量管理要求。本研究验证结果与厂家描述一致,可用于食源性病原体检测。
[1] 冯帅博.聚合酶链反应技术原理及应用[J]中国新技术新产品.2019,(14):17-18
[2] 程远霞,魏燕,鲁祥友,等.PCR 温度特性实验研究与分析[J].生命科学仪器,2008,(06):52-56
[3] 冯玉辉,尹遵义,梁兴忠,等.PCR 仪校准装置探讨[J].计量科学与技术,2021,65(08):33-35
[4] 卢旋.对于 PCR 设备温度验证的一些看法[J].工业计量.2017,27(S1):133-134.
[5] 魏群,吕丹,陈海凌.聚合酶链式反应分析仪(PCR 仪)校准装置的研究与设计[J].2019,(05):27-30
[6] CNAS-CL01:2018《检测和校准实验室认可准则》[S].2018.6:52-56.
[7] 高雯暄,甘芝霖,陈爱亮,等.核酸技术在食源性致病菌检测中的研究进展[J].食品安全质量检测学报,2017,11(24):9440-9450.
[8] 国家质量监督检验检疫总局发布中华人民共和国出入境检验检疫行业标准 SN/T 2012《食源性病原体 PCR 检测技术规范第 2 部分:PCR 仪性能试验要求》[S].2012.
[9] 饶红,韩玥,郭铮,等.转基因检测实验室实时荧光 PCR 仪期间核查方法的研究[J].现代测量与实验室管理.2015,23(01):45-47


 English
English 简体中文
简体中文






